前々回の投稿で、大気中の二酸化炭素が増加傾向にあるお話しをしましたが、今回は二酸化炭素の増加による海洋への影響についてお話しします。
海水中の水素イオン濃度(pH)は、一般的に弱アルカリ性を示し表層海水で約8.1を示しますが、水深が深くなるにつれて有機物の分解に海水中の酸素が消費され、全炭酸濃度が増加するためpHは下がる傾向にあります。
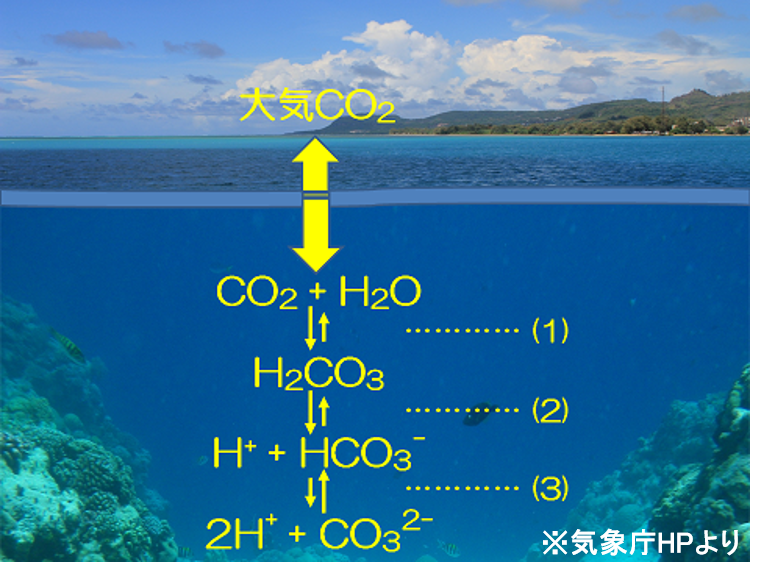
大気中の二酸化炭素は、海面を通じて大気と海洋の間で活発に出入りしています。海洋中に溶けた二酸化炭素(CO2)は、炭酸(H2CO3)となります(1)式。
CO2 + H2O ↔ H2CO3 … (1)
炭酸(H2CO3)は、海洋中では水素イオン(H+)が解離した炭酸水素イオン(HCO3–)や炭酸イオン(CO32-)との間で、(2)式と(3)式で表される反応により化学平衡の状態を保っています。
H2CO3 ↔ H+ + HCO3– … (2)
H+ + HCO3– ↔ 2 H+ + CO32- … (3)
下図に示すように、大気中の二酸化炭素が増えると海水に溶け込む二酸化炭素も増え、(1)式と(2)式の反応が下に進んで、水素イオン(H+)が発生します。発生したH+の大部分は(3)式の反応が上に進むことにより消費されますが、一部のH+はそのまま残り、CO32-が減少します。結果としてH+が増加するためpHは下がります。
このように、大気中の二酸化炭素が長期間に上昇することに伴い、海洋のpHも長期間にわたって低下する現象を「海洋酸性化」と呼んでいます。海面のpHは、産業革命前に比べてすでに0.1程度低下していると推定されています(IPCC, 2013)。
では、pHが低くなると何が問題になるのでしょうか?
海水にはカルシウムイオン(Ca2+)が含まれているので、炭酸イオン(CO32−)が一緒に存在すると、水に溶けにくい固体である炭酸カルシウム(CaCO3)を生成します。
Ca2+ + CO32− ↔ CaCO3 … (4)
海に貝類、ウニ、サンゴなど多くの炭酸カルシウム(CaCO3)の殻や骨格をもつ生物が存在するのは、簡単に炭酸カルシウム(CaCO3)の結晶体をつくれる環境にあるためです。現在は、カルシウムイオン(Ca2+)と炭酸イオン(CO32−)のそれぞれの濃度が十分に高く、 結晶ができる濃度より2〜6倍ほど 過飽和状態にあるため、きっかけさえあれば固体の炭酸カルシウム(CaCO3)を形成しやすい状態にあります。
生物はそのきっかけとなる作用を与えて、炭酸カルシウム(CaCO3)の結晶を容易に作っています。
ところが、CO2濃度が増えると、CO2自身が出す酸(H+)により炭酸イオン(CO32−)が中和されて濃度が下がり、炭酸カルシウム(CaCO3)の生成が難しくなります。
H+ + CO32- ↔ HCO3– … (5)
将来さらに炭酸イオン(CO32−)濃度が低下し過飽和度が1を割ると、化学的な制約から結晶形成は間違いなく不可能になると考えられます。進化の過程において炭酸カルシウム(CaCO3)の殻が作れないような低いpHあるいは低い炭酸イオン(CO32−)濃度を経験していない今の生物が、そのような環境に簡単に適応することは不可能で、多くの海洋生物に影響を与えることは間違えないでしょう。
気候変動に大きな影響を与えると考えられている大気中の二酸化炭素濃度の上昇ですが、海洋に与える影響による生態系の変化も懸念されます。
参考:
気象庁:海洋酸性化の知識 海洋酸性化
気象庁:海洋酸性化の知識 海洋酸性化の影響

